
تصویری: چگونه با استفاده از قانون آووگادرو حجم را پیدا می کنید؟
2024 نویسنده: Miles Stephen | [email protected]. آخرین اصلاح شده: 2023-12-15 23:35
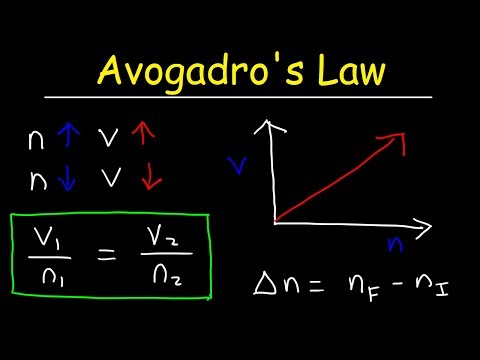
قانون آووگادرو نشان می دهد که رابطه مستقیمی بین تعداد مول های گاز و آن وجود دارد جلد . این را نیز می توان نشان داد استفاده كردن معادله: V1/n1 = V2/n2. اگر تعداد خال ها دو برابر شود جلد دو برابر خواهد شد.
به این ترتیب، فرمول قانون آووگادرو چیست؟
فرمول قانون آووگادرو در جایی که "V" حجم گاز است، "n" مقدار گاز (تعداد مول های گاز) و "k" برای فشار و دمای معین ثابت است. در حقیقت، قانون آووگادرو ، فرضیه مطرح شده توسط وی، از جمله قوانین که بر روی آن گاز ایده آل قانون بر اساس.
علاوه بر این، نمونه ای از قانون آووگادرو چیست؟ قانون آووگادرو بیان می کند که حجم گاز با تعداد مول های گاز نسبت مستقیم دارد. در اینجا برخی از مثال ها . همانطور که یک توپ بسکتبال را منفجر می کنید، مولکول های گاز بیشتری را وارد آن می کنید. هر چه تعداد مولکول ها بیشتر باشد حجم آن بیشتر می شود. هر دو بالون دارای تعداد یکسانی مولکول هستند.
علاوه بر این، قانون آووگادرو چه می گوید که آیا این آزمایشگاه قانون را اثبات می کند شما از کجا می دانید؟
یک بیانیه مدرن است : قانون آووگادرو بیان می کند که "حجم های مساوی از همه گازها، در دما و فشار یکسان، تعداد مولکول های یکسانی دارند." برای یک جرم معین از یک گاز ایده آل ، حجم و مقدار (مول) گاز هستند نسبت مستقیم با دما و فشار هستند مقدار ثابت.
قانون ترکیب حجم ها توسط فرضیه آووگادرو چگونه توضیح داده می شود؟
(آ) قانون ترکیب حجم ها توسط فرضیه آووگادرو : تمام گازهای حاوی مساوی جلدها در شرایط بیرونی دما و فشار یکسان تعداد مولکول های برابر خواهد داشت. این مولکول های گاز به نسبت اعداد کوچک کوچک واکنش نشان می دهند، بنابراین آنها (گاز) جلدها همچنین به نسبت اعداد صحیح کوچک خواهد بود.
توصیه شده:
چگونه ریشه های خیالی را با استفاده از قانون نشانه های دکارت پیدا می کنید؟

قانون نشانههای دکارت میگوید تعداد ریشههای مثبت برابر است با تغییرات در علامت f(x)، یا کمتر از آن با یک عدد زوج است (بنابراین به کم کردن 2 ادامه میدهید تا زمانی که به 1 یا 0 برسید). بنابراین، f(x) قبلی ممکن است 2 یا 0 ریشه مثبت داشته باشد. ریشه های واقعی منفی
چگونه با استفاده از قانون تجربی درصد تقریبی را پیدا می کنید؟

پیدا کردن مساحت زیر منحنی از x = 9 تا x = 13. قانون تجربی یا قانون 68-95-99.7٪ درصد تقریبی داده هایی را می دهد که در یک انحراف استاندارد (68٪)، دو انحراف استاندارد (95٪) قرار می گیرند. و سه انحراف معیار (99.7%) از میانگین
چگونه قانون آووگادرو را حل می کنید؟

در فشار و دمای ثابت، قانون آووگادرو را می توان از طریق فرمول زیر بیان کرد: V ∝ n. V/n = k. V1/n1 = V2/n2 (= k، طبق قانون آووگادرو). PV = nRT. V/n = (RT)/P. V/n = k. k = (RT)/P. یک مول گاز هلیوم یک بالون خالی را به حجم 1.5 لیتر پر می کند
چگونه قانون آووگادرو را نشان می دهید؟

قانون آووگادرو هر زمان که یک بالون را منفجر می کنید ثابت است. با اضافه کردن مول گاز به بادکنک با منفجر کردن آن، حجم بالون افزایش می یابد. اگر ظرفی که گاز را در خود نگه میدارد، به جای انعطافپذیر، سفت باشد، در قانون آووگادرو میتوان فشار را جایگزین حجم کرد
قانون آووگادرو چگونه استفاده می شود؟

قانون آووگادرو بیان می کند که حجم گاز با تعداد مول های گاز نسبت مستقیم دارد. همانطور که یک توپ بسکتبال را منفجر می کنید، مولکول های گاز بیشتری را وارد آن می کنید. هر چه تعداد مولکول ها بیشتر باشد، حجم آن بیشتر می شود. بسکتبال باد می کند
