
تصویری: اسیدها، بازها و نمک ها چیست؟
2024 نویسنده: Miles Stephen | [email protected]. آخرین اصلاح شده: 2023-12-15 23:35
یک اسید به عنوان ماده ای تعریف می شود که محلول آب آن طعم ترش می دهد، تورنسل آبی به رنگ قرمز در می آید و خنثی می شود پایه ها . نمک یک ماده خنثی است که محلول آبی آن بر تورنسل تأثیر نمی گذارد. به گزارش فرادید: اسیدها , پایه ها و نمک ها الکترولیت نامیده می شوند.
همچنین بدانید که با مثال اسید باز و نمک چیست؟
مشترک مثال ها شامل هیدروکسید سدیم، هیدروکسید منیزیم، کربنات هیدروژن سدیم (بی کربنات سدیم)، هیپوکلریت سدیم و آمونیاک است. خنثی سازی یک واکنش بین یک است اسید و قلیایی که a را تشکیل می دهد نمک و آب. اسیدها می تواند با برخی فلزات واکنش داده و الف را تشکیل دهد نمک و گاز هیدروژن
به طور مشابه، کاربرد اسیدها، بازها و نمک ها چیست؟ در صنایع شیمیایی، اسیدها واکنش در واکنش های خنثی سازی برای تولید نمک ها . مثلا نیتریک اسید با آمونیاک واکنش نشان می دهد و نیترات آمونیوم، یک کود تولید می کند. علاوه بر این، کربوکسیلیک اسیدها را می توان با الکل ها برای تولید استر استری کرد.
همچنین بدانید که تفاوت بین اسید پایه و نمک چیست؟
اسید حاوی مقدار زیادی یون و طعم ترش است. نمک زمانی تشکیل می شود که اسید و پایه هر دو با هم مخلوط می شوند و خنثی می شوند. یون های منفی آب را تشکیل می دهند در حالی که یون های مثبت تشکیل می شوند نمک . با این حال، هر دو اسیدها و پایه ها ماهیت خورنده و آزمایشگاهی دارند اسیدها و پایه ها می تواند به پوست و همچنین فلزات آسیب برساند.
به چه چیزی پایه گفته می شود؟
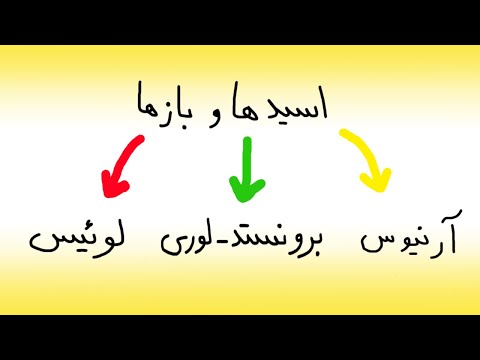
در شیمی، الف پایه یک گونه شیمیایی است که الکترون اهدا می کند، پروتون می پذیرد یا یون های هیدروکسید (OH-) را در محلول آبی آزاد می کند. پایه ها ویژگی های مشخصه خاصی را نشان می دهد که می تواند برای کمک به شناسایی آنها استفاده شود. انواع پایه ها از جمله آرنیوس پایه ، برونستد-لوری پایه ، و لوئیس پایه.
توصیه شده:
تفاوت اسیدها و بازها در مقیاس pH چیست؟

تمایز بین اسیدها و بازها تفاوت کلیدی: اسیدها و بازها دو نوع ماده خورنده هستند. هر ماده ای با مقدار pH بین 0 تا 7 اسیدی در نظر گرفته می شود، در حالی که مقدار apH 7 تا 14 یک باز است. اسیدها ترکیبات یونی هستند که در آب از هم جدا می شوند و یک یون هیدروژن (H+) تشکیل می دهند
اسیدها و بازها در شیمی چیست؟

در شیمی، اسیدها و بازها با سه مجموعه تئوری متفاوت تعریف شده اند. یکی تعریف آرنیوس است که حول این ایده می چرخد که اسیدها موادی هستند که در یک محلول آبی یونیزه می شوند (شکسته می شوند) تا یون های هیدروژن (H+) تولید کنند در حالی که بازها یون های هیدروکسید (OH-) را در محلول تولید می کنند
تفاوت بین تعریف آرنیوس و تعریف برونستد لوری از اسیدها و بازها چیست؟

تفاوت بین این سه نظریه این است که نظریه آرنیوس بیان می کند که اسیدها همیشه حاوی H+ و بازها همیشه حاوی OH- هستند. در حالی که مدل برونستد-لوری ادعا می کند که اسیدها دهنده پروتون و گیرنده پروتون هستند، بنابراین بازها نیازی به OH- ندارند، بنابراین اسیدها یک پروتون به آب می دهند که H3O+ را تشکیل می دهد
مفهوم آرنیوس از اسیدها و بازها چیست؟

مفهوم اسید-باز آرنیوس، ماده ای را به عنوان اسید طبقه بندی می کند که یون هیدروژن H(+) یا یون هیدرونیوم در آب تولید کند. اگر ماده ای یون هیدروکسید OH(-) در آب تولید کند به عنوان پایه طبقه بندی می شود. راه های دیگر طبقه بندی مواد به عنوان اسید یا باز، مفهوم برونستد-لوری و مفهوم لوئیس است
اسیدها و بازها بر اساس نظریه برونستد لوری چیست؟

در سال 1923، شیمیدانان یوهانس نیکولاس برونستد و توماس مارتین لوری به طور مستقل تعاریفی از اسیدها و بازها را بر اساس توانایی ترکیبات برای اهدا یا پذیرش پروتون (یون H+) ارائه کردند. در این نظریه، اسیدها به عنوان دهنده پروتون تعریف می شوند. در حالی که بازها به عنوان پذیرنده پروتون تعریف می شوند
