
تصویری: چگونه میانگین وزنی یک ایزوتوپ را پیدا می کنید؟

2024 نویسنده: Miles Stephen | [email protected]. آخرین اصلاح شده: 2023-12-15 23:35
کلر ایزوتوپ با 18 نوترون دارای فراوانی 0.7577 و عدد جرمی 35 amu است. برای محاسبه میانگین جرم اتمی، کسر را در عدد جرمی برای هر یک ضرب کنید ایزوتوپ ، سپس آنها را با هم اضافه کنید.
به طور مشابه، میانگین وزنی همه ایزوتوپ های یک عنصر چقدر است؟
با استفاده از توده های مختلف ایزوتوپ ها و هر کدام چقدر فراوان ایزوتوپ است، ما می توانیم پیدا کنیم میانگین جرم اتم های یک عنصر . جرم اتمی یک عنصر هست میانگین وزنی جرم اتم ها در یک نمونه طبیعی از عنصر . جرم اتمی معمولاً بر حسب واحد جرم اتمی گزارش می شود.
جرم 1 amu چیست؟ یک واحد جرم اتمی (با نماد AMU یا amu) دقیقاً به اندازه 1/12 جرم یک اتم کربن 12 تعریف می شود. اتم کربن 12 (C-12) دارای شش اتم است پروتون ها و شش نوترون ها در هسته آن به عبارتی نادقیق، یک AMU میانگین است پروتون توده استراحت و نوترون توده استراحت
دوم اینکه چگونه درصد فراوانی را با استفاده از جرم اتمی محاسبه می کنید؟
هر کدام را تغییر دهید درصد فراوانی به شکل اعشاری با تقسیم بر 100. این مقدار را در ضرب کنید جرم اتمی از آن ایزوتوپ برای به دست آوردن میانگین، برای هر ایزوتوپ با هم جمع کنید جرم اتمی.
تفاوت بین جرم اتمی و وزن اتمی چیست؟
جرم اتمی (مآ) هست جرم از یک اتم . یک مجرد اتم دارای تعدادی پروتون و نوترون است، بنابراین جرم بدون ابهام است (تغییر نمی کند) و مجموع تعداد پروتون ها و نوترون ها است. در اتم . وزن اتمی میانگین موزون است جرم از همه اتم ها یک عنصر، بر اساس فراوانی ایزوتوپ ها.
توصیه شده:
میانگین وزنی را چگونه تفسیر می کنید؟

خلاصه. میانگین وزنی: میانگینی که در آن برخی از ارزش ها بیشتر از سایرین نقش دارند. هنگامی که وزن ها به 1 اضافه می شوند: فقط هر وزن را در مقدار منطبق ضرب کنید و همه را جمع کنید. در غیر این صورت، هر وزن w را در مقدار منطبق آن x ضرب کنید، همه را جمع کنید، و بر مجموع اوزان تقسیم کنید: میانگین وزنی = ΣwxΣw
وقتی میانگین داده می شود چگونه عدد گم شده را پیدا می کنید؟

میانگین مجموعه ای از اعداد، میانگین آن اعداد است. شما می توانید با اضافه کردن مجموعه اعداد و تقسیم بر تعداد اعدادی که داده می شود، themean را پیدا کنید. اگر themean به شما داده می شود و از شما خواسته می شود یک عدد گمشده را از این مجموعه پیدا کنید، از یک معادله ساده استفاده کنید
چگونه انحراف معیار و میانگین را در اکسل پیدا می کنید؟
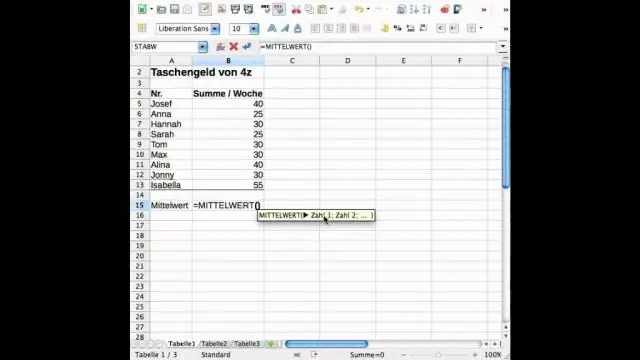
انحراف معیار معیاری است که نشان می دهد چقدر واریانس در مجموعه ای از اعداد در مقایسه با میانگین (میانگین) اعداد وجود دارد. برای محاسبه انحراف استاندارد در اکسل، بسته به مجموعه داده، می توانید از یکی از دو تابع اصلی استفاده کنید. اگر داده ها کل جمعیت را نشان می دهند، می توانید از STDEV استفاده کنید. عملکرد
چگونه می توان میانگین وزنی را در جدول محوری ایجاد کرد؟

میانگین وزنی در یک PivotTable روی فلش رو به پایین در کنار کلمه PivotTable در سمت چپ نوار ابزار PivotTable کلیک کنید. فرمول ها را انتخاب کنید | فیلدهای محاسبه شده در کادر نام، یک نام برای فیلد جدید خود وارد کنید. در کادر Formula، فرمولی را که می خواهید برای میانگین وزنی خود استفاده کنید، وارد کنید، مانند =WeightedValue/Weight. روی OK کلیک کنید
چگونه میانگین را در نمودار پیدا می کنید؟
برای یافتن میانگین، اعداد را جمع کرده و آن را بر تعداد اضافات تقسیم کنید
